
1. 필요한 개념 및 해설
'계'와 '주위'의 개념에 대해 알고 있어야 한다.
'계'란 우리의 관심이 되는 우주의 한 부분을 의미하고, 계를 제외한 나머지 부분을 주위라 한다. 계와 주위를 합쳐서 '우주'라고 부른다. 계의 종류는 아래와 같이 나눌 수 있다.
- 고립계 : 주위와 물질 및 에너지 교환이 모두 불가능
- 닫힌계 : 주위와 에너지는 교환할 수 있으나 물질 교환은 불가능
- 열린계 : 주위와 물질 및 에너지 교환이 모두 가능
필요한 개념을 알았으니 문제를 풀어본다. 문제에서 두번째 문장을 해석할 수 있는지가 핵심이다. 마지막 문장을 통해 보온병 내부가 '계'임을 알 수 있다.
"보온병(계)은 이상적으로 완벽하게 단열되어 있으며"에서 단열에 주목해야한다. 단열이란 Q=0인 상태이므로 계로 열출입이 없다는 의미다. 다만, 이 조건만으로 에너지 교환이 없는지는 알 수 없다. 일에 대한 언급이 없으므로 일의 변화량은 존재할 수도 있다는 점을 유의해야 한다. 아래 '나의 생각'에 이 부분에 대한 얘기를 풀어보았다.
"물은 보온병(계) 외부로 전혀 새어 나오지 않는다고 가정한다"에서 물질 교환이 불가능한 계라는 것을 알 수 있다. 또한 첫번째 문장에서 밀봉이라는 표현도 물질 교환이 불가능하다는 점을 강조해주는 표현이다.
따라서 선지 4번에서 일의 출입이 불가능한 계라는 설명이 틀렸다.
2. 나의 생각
실제 시험장에서 굉장히 헷갈렸던 문제였다. 일에 대한 언급이 없는데 이걸 어떻게 판단해야 할지 꽤 고민을 했었다. 열역학 문제를 다 풀고와서 고민하던중 불현듯 보온병의 부피가 변할수도 있겠다는 생각이 들었다. 극단적으로 보온병이 깨지지 않는 선에서 보온병을 압축시키면 보온병(계)의 부피가 변하니 일의 출입이 가능하겠다는 생각이 들어 4번 설명이 틀리지 않을까라고 생각하고 넘어갔었다.
우리는 이 문제를 통해 언급되지 않은 사항은 가능성을 최대한 열어둬야 한다는 점을 배우고 넘어가면 된다.

1. 필요한 개념 및 해설

왼쪽은 냉동기 성능계수의 기본식이다. 이상적인 카르노냉동기의 경우에는 온도만으로 성능계수를 계산할 수 있다. Qc는 냉동속도, W는 일을 의미한다.
이 문제에 식을 적용하면, 냉동속도는 5kW, 일에 해당하는 동력은 2kW이므로 성능계수는 5/2 = 2.5이다.
2. 나의 생각
열기관 효율과 냉동기 성능계수에 관한 문제는 기출에 정말 많이 나온 빈출주제이다. 관련 식은 필수로 암기해야한다. 또한, 이 문제에서는 그냥 냉동속도를 줬지만 문제를 조금 꼬아서 Qh와 W를 이용해 Qc를 숨길수도 있다. 주어진 조건이 냉동속도인지 꼼꼼하게 확인하자.

1. 필요한 개념 및 해설
혼합물에서 열역학적 성질은 순수한 상태에서의 열역학적 성질들의 합과 섞이면서 발생하는 변화량까지 고려해줘야 한다. 하지만 섞여도 혼합에 따른 변화량이 없는 특이한 경우도 있기 때문에 이 특이한 상황을 문제로 종종 묻곤 한다. 이상기체일때와 이상용액일때 두가지 경우를 알아두면 된다.
- 이상기체 혼합물인 경우 : 내부에너지, 엔탈피
- 이상용액 혼합물인 경우 : 부피, 엔탈피
이상기체 혼합물의 경우 식으로 표현하면 아래와 같다.

엔탈피만 몰분율에 대한 항이 없고 나머지는 몰분율에 대한 항이 있는데 이 항이 혼합에 따른 변화량을 의미한다. 이상기체 혼합물에서 자세한 유도과정이 궁금하다면 아래 링크를 참고하면 된다. 다만 내용이 쉽지 않기 때문에 그냥 저렇게 유도되는구나 정도로만 알면 된다.
https://chembeginer.tistory.com/5
문제에서는 '혼합 전 순수성분들의 성질에 그 성분의 몰수를 곱한 값의 합과 같은 것'을 묻고 있다. 몰분율인 yi는 i 성분의 몰수를 전체 몰수로 나눈 값이므로 전체 몰수를 양변에 곱해주면 문제에서 말하는 내용과 정확히 일치한다.
2. 나의 생각
용액 열역학파트 중 비교적 쉬운 문제라고 생각한다. 식까지 함께 외워두자.

1. 필요한 개념 및 해설
2성분계 상평형도를 해석할 수 있는지 물어보는 문제다. 흔히 물어보는 상평형도는 '압력-조성'이나 '온도-조성' 상평형도이다. 이 문제는 압력-조성 기액 상평형도이다.
압력-조성 상평형도는 압력이 높은 곳이 액체, 낮은 곳이 기체이며 가운데 곡선으로 둘러쌓인 영역은 액체와 기체가 공존하는 영역이다. 과냉각액체인 a에서 조성이 일정한 상태로 압력이 낮아지게 되면 포화액체인 b점에 도달하게 되고, 압력이 더 낮아지게 되면 포화증기인 c점을 지나 과열증기인 d점에 다다르게 된다. 액체에서 기포가 생기는 순간을 기포점(bubble point)이라 하고, 기체에서 액체방울이 생기는 순간은 이슬점(dew point)이라 한다. 기포점과 이슬점을 그래프에 적용하면 b, e, g를 통과하는 곡선은 기포점들의 선이고, c, f, h를 통과하는 곡선은 이슬점들의 선이다. 그림으로 표현하면 아래와 같다.
위의 설명으로 선지 1, 2, 4의 설명을 갈음하고, 선지 3이 틀린 이유를 살펴보겠다. 그래프의 x축은 성분 1의 조성이므로 점 g에서 성분 1의 액체상 조성은 0.25이고, 성분 1의 기체상 조성은 0.5이다. 이성분계이므로 전체 조성의 합은 1이라는 것을 이용해 성분 2의 조성을 계산할 수 있다.
성분 2의 액체상 조성 = 1 - 0.25 = 0.75
성분 2의 기체상 조성 = 1 - 0.5 = 0.5
따라서 점 g에서 성분 2의 액체상에서의 조성은 0.5가 아니라 0.75이다.
2. 나의 생각
최근 7급 기출에도 있었던 문제인만큼 절대 틀려서는 안된다. y축이 압력인지, 온도인지만 잘보자. y축이 온도인 경우는 압력과 반대라고 생각하면되고 기본 원리는 동일하다.
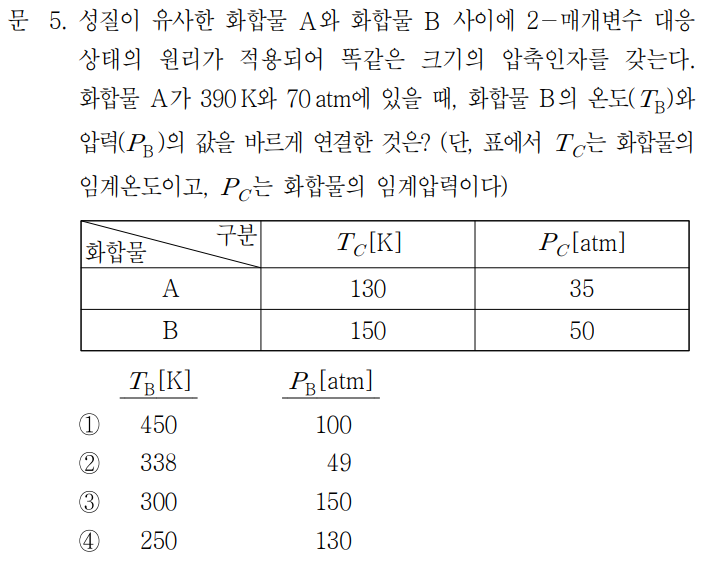
1. 필요한 개념 및 해설
이 문제는 대응상태의 원리를 알고 있어야 풀 수 있는 문제다. 대응상태의 원리란 아래와 같다.
"모든 유체들은 동일한 환산온도와 환산압력에서 비교할 경우 대체로 거의 같은 압축인자들을 가지며 이상기체 거동으로부터 벗어나는 정도도 거의 비슷하다"
이 원리를 문제에 적용해보면, 화합물 A와 B가 똑같은 크기의 압축인자를 갖는다는 말은 화합물 A와 B의 환산온도와 환산압력이 동일하다고 해석할 수 있다. 여기서 환산온도와 환산압력의 정의는 아래와 같다.

화합물 A의 주어진 온도와 압력이 390K, 70atm 이므로 A의 환산온도는 390/130 = 3, 환산압력은 70/35 = 2 다. 이 환산온도와 환산압력이 화합물 B와 동일하므로 B의 온도는 3 × 150 = 450K 이고, 압력은 2 × 50 = 100atm 이다.
2. 나의 생각
대응상태의 원리도 여러번 기출된 내용이다. 압축인자 개념과 식까지 꼭 알아둬야한다.
'합격자가 푸는 기출해설 > 22년 국가직 7급' 카테고리의 다른 글
| 22년 전달현상 나책형 1~5문 (0) | 2023.09.02 |
|---|---|
| 22년 화공열역학 나책형 21~25문 (0) | 2023.07.29 |
| 22년 화공열역학 나책형 16~20문 (0) | 2023.02.22 |
| 22년 화공열역학 나책형 11~15문 (0) | 2023.02.18 |
| 22년 화공열역학 나책형 6~10문 (0) | 2023.02.16 |



